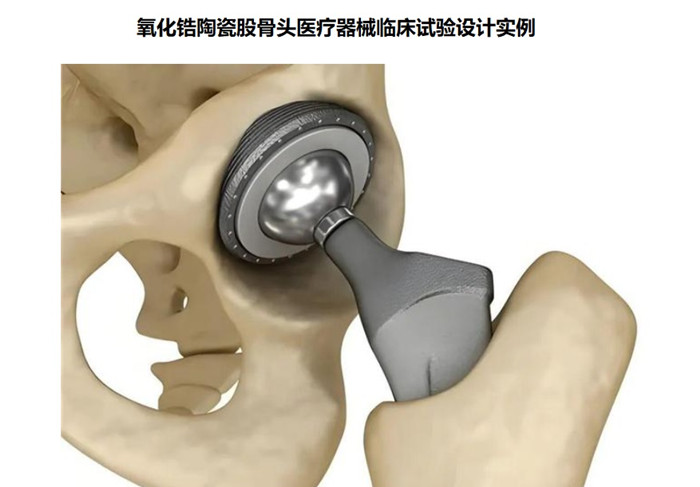
氧化鋯陶瓷股骨頭為髖關(guān)節(jié)假體組件���,股骨柄部插入股骨髓腔內(nèi)后����, 陶瓷股骨頭與髖臼內(nèi)襯���、髖臼(外)杯形成旋轉(zhuǎn)關(guān)節(jié)面��, 實(shí)現(xiàn)髖關(guān)節(jié)的運(yùn)動(dòng)���。利用機(jī)械原理形成新的關(guān)節(jié)活動(dòng)。氧化鋯陶瓷股骨頭在我國(guó)屬于第三類醫(yī)療器械注冊(cè)產(chǎn)品����,目前,需要通過(guò)醫(yī)療器械臨床試驗(yàn)完成臨床評(píng)價(jià)��,本文為大家介紹氧化鋯陶瓷股骨頭醫(yī)療器械臨床試驗(yàn)設(shè)計(jì)實(shí)例�����,一起看正文�。
氧化鋯陶瓷股骨頭為髖關(guān)節(jié)假體組件,股骨柄部插入股骨髓腔內(nèi)后����,
陶瓷股骨頭與髖臼內(nèi)襯、髖臼(外)杯形成旋轉(zhuǎn)關(guān)節(jié)面��,
實(shí)現(xiàn)髖關(guān)節(jié)的運(yùn)動(dòng)����。利用機(jī)械原理形成新的關(guān)節(jié)活動(dòng)�����。氧化鋯陶瓷股骨頭在我國(guó)屬于第三類醫(yī)療器械注冊(cè)產(chǎn)品����,目前�,需要通過(guò)醫(yī)療器械臨床試驗(yàn)完成臨床評(píng)價(jià),本文為大家介紹氧化鋯陶瓷股骨頭醫(yī)療器械臨床試驗(yàn)設(shè)計(jì)實(shí)例�����,一起看正文���。
一�、氧化鋯陶瓷股骨頭醫(yī)療器械臨床試驗(yàn)設(shè)計(jì)要點(diǎn)
申請(qǐng)人選擇臨床試驗(yàn)路徑進(jìn)行臨床評(píng)價(jià)���,臨床試驗(yàn)的目的為評(píng)價(jià)確認(rèn)氧化鋯陶瓷股骨頭在預(yù)期用途下的安全有
效性�。臨床試驗(yàn)的設(shè)計(jì)為采用前瞻性���、多中心��、隨機(jī)平行對(duì)
照的試驗(yàn)設(shè)計(jì)��,選擇的對(duì)照器械為陶瓷股骨頭 BIOLOX DELTA
Ceramic Femoral Head(國(guó)械注進(jìn) 20183132567)��,重要的入選標(biāo)準(zhǔn)為患者年齡 18-80 歲(含)�,性別不限,低于
50 歲的患者應(yīng)有手術(shù)的緊迫性訴求���;患者骨骼已成熟���;患者具有髖關(guān)節(jié)置換手術(shù)適應(yīng)癥���;參與試驗(yàn)的一側(cè)患肢為初次接受髖關(guān)節(jié)置換�����;受試者或其監(jiān)護(hù)人愿意并且能夠簽署
知情同意書(shū)�。重要的排除標(biāo)準(zhǔn)為有髖關(guān)節(jié)置換術(shù)手術(shù)禁忌癥�;已知患者對(duì)一種或多種植入材料有過(guò)敏史;肥胖BMI>35���;孕婦或哺乳期婦女���;髖關(guān)節(jié)發(fā)育不良CROWE分級(jí)
3�、4 級(jí)�;體質(zhì)虛弱或因全身其他疾病不能耐受手術(shù)者,及預(yù)期壽命不足 2 年者�����;其他研究者認(rèn)為患者不適合本試
驗(yàn)的原因��。
二�����、氧化鋯陶瓷股骨頭醫(yī)療器械臨床試驗(yàn)需要多少受試者��,需要在幾家醫(yī)院開(kāi)展����?
臨床試驗(yàn)在4 家臨床機(jī)構(gòu)(南京大學(xué)醫(yī)學(xué)院附屬鼓樓醫(yī)
院、吉林大學(xué)中日聯(lián)誼醫(yī)院�����、中國(guó)人民解放軍陸軍軍醫(yī)大
學(xué)第二附屬醫(yī)院、河南省洛陽(yáng)正骨醫(yī)院(河南省骨科醫(yī)
院))開(kāi)展��,計(jì)劃入組 144 例����,實(shí)際入組 144 例受試者,其
中���,F(xiàn)AS 集試驗(yàn)組 71 例,對(duì)照組 71 例; PPS 集試驗(yàn)組 63 例,對(duì)
照組 69 例; SS 集試驗(yàn)組 71 例,對(duì)照組 71 例���。
三、氧化鋯陶瓷股骨頭醫(yī)療器械臨床試驗(yàn)的主要評(píng)價(jià)指標(biāo)是什么���?
臨床試驗(yàn)的主要評(píng)價(jià)指標(biāo):術(shù)后 12 個(gè)月的 Harris 評(píng)分
優(yōu)良率作為主要評(píng)價(jià)指標(biāo)�。 Harris 評(píng)分的內(nèi)容包括疼痛�����、
功能�、畸形和關(guān)節(jié)活動(dòng)度四個(gè)方面�����,側(cè)重于患者疼痛及關(guān)
節(jié)功能方面評(píng)價(jià)的同時(shí)��,加入了關(guān)節(jié)活動(dòng)度方面的權(quán)重。
四��、氧化鋯陶瓷股骨頭醫(yī)療器械臨床試驗(yàn)的次要評(píng)價(jià)指標(biāo)是什么���?
次要評(píng)價(jià)指標(biāo):包括療效指標(biāo)和安全性指標(biāo)�。采集術(shù)
后�、6 周、3 個(gè)月���、6 個(gè)月的 Harris 評(píng)分���,觀察各個(gè)隨訪點(diǎn)
兩組間的療效評(píng)分差異。同時(shí)能夠構(gòu)建受試者術(shù)后的完整
康復(fù)曲線�。
五、氧化鋯陶瓷股骨頭醫(yī)療器械臨床試驗(yàn)的安全性指標(biāo)是什么�����?
安全性指標(biāo)方面選取影像學(xué)數(shù)據(jù)�、實(shí)驗(yàn)室檢查及不良
事件發(fā)生率、假體生存率等客觀指標(biāo)�����,評(píng)價(jià)本產(chǎn)品在臨床
試驗(yàn)中的安全性。
六����、氧化鋯陶瓷股骨頭醫(yī)療器械臨床試驗(yàn)真實(shí)試驗(yàn)結(jié)果
臨床試驗(yàn)結(jié)果:主要有效性評(píng)價(jià)指標(biāo) FAS 分析集中,試
驗(yàn)組術(shù)后 12 個(gè)月 Harris 評(píng)分優(yōu)良率為 97.18%�,對(duì)照組術(shù)后
12 個(gè)月 Harris 評(píng)分優(yōu)良率為 98.59%,組間比較術(shù)后 12 個(gè)月
Harris 評(píng)分優(yōu)良率無(wú)統(tǒng)計(jì)學(xué)差異(P=0.564)��,兩組率差 95%
置信區(qū)間為(-8.67%, 5.16%)�。PPS 分析集中,試驗(yàn)組術(shù)后 12個(gè)月Harris評(píng)分優(yōu)良率為98.41%�����,對(duì)照組術(shù)后12個(gè)月Harris
評(píng)分優(yōu)良率為 98.55%��,組間比較術(shù)后 12 個(gè)月 Harris 評(píng)分優(yōu)
良率無(wú)統(tǒng)計(jì)學(xué)差異(P=0.966)���,兩組率差 95%置信區(qū)間為(-
7.49%, 6.44%)。FAS 和 PPS 集,優(yōu)效性/非劣效假設(shè)成立�。次要
療效指標(biāo)方面,試驗(yàn)組和對(duì)照組在術(shù)后±7 天�����、術(shù)后 6 周±
7 天、術(shù)后 3 個(gè)月±15 天�����、術(shù)后 6 個(gè)月±30 天��、術(shù)后 12 個(gè)
月±30 天等各次訪視的 Harris 優(yōu)良率均無(wú)顯著性差異�����。
安全性評(píng)價(jià):對(duì)照組嚴(yán)重不良事件為 1 例����;1 例患者系
間質(zhì)性肺炎伴感染及Ⅰ型呼吸衰竭死亡;1 例患者因死亡退
出試驗(yàn)����,系因食道癌去世。臨床試驗(yàn)未發(fā)生與申報(bào)產(chǎn)品相關(guān)的不良事件��。此外�,補(bǔ)充臨床試驗(yàn)報(bào)告中顯示,在平均隨訪時(shí)間為 46.73±3.60 個(gè)月���,中位隨訪時(shí)間 47 個(gè)月時(shí)�����,兩
組均未發(fā)現(xiàn)有因申報(bào)產(chǎn)品質(zhì)量問(wèn)題導(dǎo)致的嚴(yán)重不良事件�����,
無(wú)假體破碎��。