為貫徹落實國務(wù)院和上海市政府關(guān)于高水平制度型開放的方案要求,充分發(fā)揮中國(上海)自貿(mào)試驗區(qū)(含臨港新片區(qū)����,以下簡稱上海自貿(mào)試驗區(qū))先行先試作用,規(guī)范進(jìn)口醫(yī)療器械加貼中文標(biāo)簽的行為,根據(jù)《醫(yī)療器械監(jiān)督管理條例》�、《醫(yī)療器械說明書和標(biāo)簽管理規(guī)定》以及其他國家有關(guān)要求,制定《中國(上海)自由貿(mào)易試驗區(qū)進(jìn)口醫(yī)療器械加貼中文標(biāo)簽規(guī)定(試行)》��。
引言:為貫徹落實國務(wù)院和上海市政府關(guān)于高水平制度型開放的方案要求��,充分發(fā)揮中國(上海)自貿(mào)試驗區(qū)(含臨港新片區(qū)�����,以下簡稱上海自貿(mào)試驗區(qū))先行先試作用���,規(guī)范進(jìn)口醫(yī)療器械加貼中文標(biāo)簽的行為�����,根據(jù)《醫(yī)療器械監(jiān)督管理條例》���、《醫(yī)療器械說明書和標(biāo)簽管理規(guī)定》以及其他國家有關(guān)要求,制定《中國(上海)自由貿(mào)易試驗區(qū)進(jìn)口醫(yī)療器械加貼中文標(biāo)簽規(guī)定(試行)》�。
中國(上海)自由貿(mào)易試驗區(qū)進(jìn)口醫(yī)療器械加貼中文標(biāo)簽規(guī)定(試行)
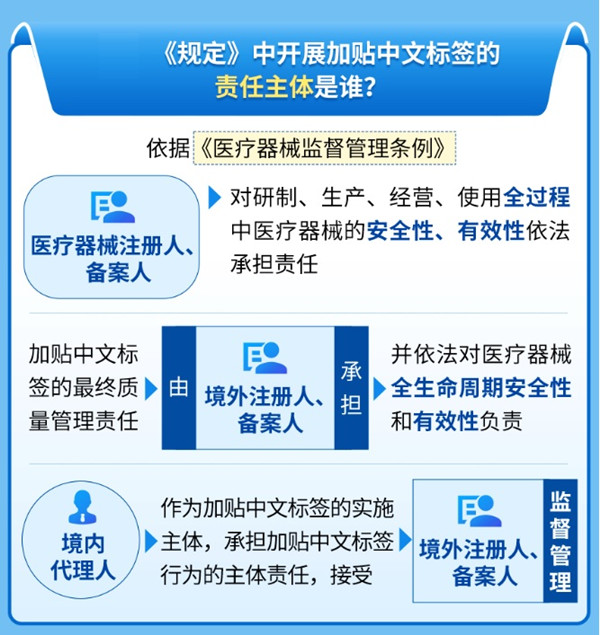
第一條 為深入貫徹國務(wù)院《全面對接國際高標(biāo)準(zhǔn)經(jīng)貿(mào)規(guī)則推進(jìn)中國(上海)自由貿(mào)易試驗區(qū)高水平制度型開放總體方案》,發(fā)揮中國(上海)自由貿(mào)易試驗區(qū)(含臨港新片區(qū)�����,以下簡稱上海自貿(mào)試驗區(qū))先行先試作用,規(guī)范進(jìn)口醫(yī)療器械加貼中文標(biāo)簽的行為�,根據(jù)《醫(yī)療器械監(jiān)督管理條例》《醫(yī)療器械說明書和標(biāo)簽管理規(guī)定》以及國家有關(guān)要求,制定本規(guī)定�����。
第二條 在上海自貿(mào)試驗區(qū)進(jìn)口醫(yī)療器械�,且境外注冊人、備案人指定的境內(nèi)代理人住所在上海自貿(mào)試驗區(qū)內(nèi)的�����,境內(nèi)代理人在海關(guān)特殊監(jiān)管區(qū)域內(nèi)為進(jìn)口醫(yī)療器械粘貼中文標(biāo)簽����、放置中文說明書的行為(以下統(tǒng)稱“加貼中文標(biāo)簽”),按照本規(guī)定執(zhí)行���。
第三條 境內(nèi)代理人協(xié)助境外注冊人����、備案人開展加貼中文標(biāo)簽的活動�,接受境外注冊人����、備案人監(jiān)督管理�����。加貼中文標(biāo)簽的最終責(zé)任由境外注冊人�����、備案人承擔(dān)�����,境外注冊人���、備案人依法對醫(yī)療器械全生命周期安全性和有效性負(fù)責(zé)。
境外注冊人��、備案人指定的境內(nèi)代理人應(yīng)當(dāng)與國家藥品監(jiān)督管理局《醫(yī)療器械注冊證》或《第一類醫(yī)療器械備案信息表》上所載明的代理人一致�。
第四條 上海市藥品監(jiān)督管理局負(fù)責(zé)上海自貿(mào)試驗區(qū)加貼醫(yī)療器械中文標(biāo)簽行為的監(jiān)督管理,指導(dǎo)浦東新區(qū)市場監(jiān)督管理局對本行政區(qū)域內(nèi)加貼中文標(biāo)簽行為的監(jiān)督管理工作�����。
浦東新區(qū)市場監(jiān)督管理局負(fù)責(zé)本行政區(qū)域加貼中文標(biāo)簽行為的監(jiān)督管理��。
第五條 從事進(jìn)口醫(yī)療器械加貼中文標(biāo)簽活動的境內(nèi)代理人,具備下列條件:
(一)熟悉醫(yī)療器械相關(guān)法規(guī)���、規(guī)章��、標(biāo)準(zhǔn)要求��;
(二)有與加貼中文標(biāo)簽相適應(yīng)的場地���、設(shè)施設(shè)備,貯存和環(huán)境條件����;
(三)有熟悉加貼中文標(biāo)簽管理的組織機(jī)構(gòu)和人員;
(四)有受境外注冊人�、備案人識別和確定的質(zhì)量管理體系;
(五)有運(yùn)用信息化手段實施質(zhì)量管理體系的能力�����。
第六條 境內(nèi)代理人加貼中文標(biāo)簽���,應(yīng)登錄上海市一網(wǎng)通辦在線政務(wù)服務(wù)平臺�����,提交以下資料:
(一)境外注冊人�����、備案人與境內(nèi)代理人關(guān)于加貼中文標(biāo)簽的質(zhì)量授權(quán)及質(zhì)量協(xié)議���;
(二)加貼中文標(biāo)簽質(zhì)量管理體系文件(含作業(yè)指導(dǎo)書及操作規(guī)程等)目錄;
(三)加貼中文標(biāo)簽的醫(yī)療器械產(chǎn)品注冊����、備案信息;
(四)與注冊或者備案信息一致的中文標(biāo)簽��、說明書樣稿�����;
(五)境內(nèi)代理人法定代表人���、企業(yè)負(fù)責(zé)人身份證明�����;
(六)加貼中文標(biāo)簽場地的相關(guān)證明文件���。
第七條 境內(nèi)代理人應(yīng)當(dāng)誠實守信����,禁止任何虛假����、欺騙行為。報告資料客觀真實��、不得隱瞞和編造�。
境內(nèi)代理人在接受監(jiān)督管理部門檢查時,應(yīng)當(dāng)予以配合�。
第八條 加貼中文標(biāo)簽場所為醫(yī)療器械專用倉庫且設(shè)置在上海自貿(mào)試驗區(qū)海關(guān)特殊監(jiān)管區(qū)域內(nèi),加貼中文標(biāo)簽場所與加貼中文標(biāo)簽規(guī)模���、品種相適應(yīng)�����,區(qū)域獨(dú)立并設(shè)置醒目標(biāo)識�����,不得與其他非醫(yī)療器械產(chǎn)品共用倉庫或者貯存區(qū)域���,避免混淆或污染�。
第九條 境內(nèi)代理人應(yīng)當(dāng)建立與境外注冊人�����、備案人有效銜接的醫(yī)療器械質(zhì)量管理體系��,并確保在其管控下��,執(zhí)行境外注冊人����、備案人加貼中文標(biāo)簽的具體要求���,采用信息化技術(shù)�����,保證加貼中文標(biāo)簽的醫(yī)療器械可追溯��。
第十條 境內(nèi)代理人應(yīng)當(dāng)建立進(jìn)口醫(yī)療器械產(chǎn)品加貼中文標(biāo)簽相關(guān)基礎(chǔ)數(shù)據(jù)庫���,對標(biāo)簽���、說明書版本信息進(jìn)行控制,確保與有效的進(jìn)口醫(yī)療器械產(chǎn)品注冊或備案信息保持一致��。
第十一條 境內(nèi)代理人接受境外注冊人�、備案人委托進(jìn)行加貼中文標(biāo)簽產(chǎn)品放行的,應(yīng)當(dāng)獲得境外注冊人�、備案人的書面授權(quán),按照境外注冊人����、備案人明確的放行規(guī)程、放行標(biāo)準(zhǔn)����、放行條件,審核加貼中文標(biāo)簽過程記錄�����,并對產(chǎn)品進(jìn)行檢查�����;符合標(biāo)準(zhǔn)和條件的,經(jīng)授權(quán)的放行人員簽字后方可上市�����。
加貼中文標(biāo)簽應(yīng)當(dāng)符合相關(guān)強(qiáng)制性標(biāo)準(zhǔn)要求�,內(nèi)容與經(jīng)注冊或者備案的相關(guān)內(nèi)容一致。不符合法律�、法規(guī)��、規(guī)章����、強(qiáng)制性標(biāo)準(zhǔn)要求或與注冊/備案信息不一致的,境內(nèi)代理人不得放行���。
第十二條 境內(nèi)代理人應(yīng)當(dāng)建立加貼中文標(biāo)簽糾正措施程序及預(yù)防措施程序�����。發(fā)現(xiàn)加貼中文標(biāo)簽產(chǎn)品出現(xiàn)標(biāo)識錯誤�����、標(biāo)簽混淆�����、標(biāo)簽印刷錯誤等問題的���,境內(nèi)代理人應(yīng)當(dāng)采取糾正措施��。發(fā)現(xiàn)產(chǎn)生問題原因涉及境外注冊人���、備案人的,及時通報境外注冊人�����、備案人��。
第十三條 境內(nèi)代理人應(yīng)當(dāng)建立加貼中文標(biāo)簽活動質(zhì)量管理體系內(nèi)部審核程序��,以確保其持續(xù)有效���。
境內(nèi)代理人每年一次接受境外注冊人���、備案人加貼中文標(biāo)簽活動的質(zhì)量管理體系評審。
第十四條 境內(nèi)代理人于每年3月31日前�����,依規(guī)向上海市藥品監(jiān)督管理局提交境外注冊人、備案人加貼中文標(biāo)簽質(zhì)量管理體系年度自查報告�。本規(guī)定第六條報告事項發(fā)生變化的,一并在自查報告中列明����。
第十五條 按照本規(guī)定要求,上海市藥品監(jiān)督管理局�、浦東新區(qū)市場監(jiān)督管理局對開展加貼中文標(biāo)簽的境內(nèi)代理人開展現(xiàn)場檢查,對下列事項重點檢查:
(一)執(zhí)行醫(yī)療器械法規(guī)規(guī)章�、質(zhì)量管理規(guī)范情況�;
(二)質(zhì)量管理體系運(yùn)行是否持續(xù)合規(guī)、有效����;
(三)質(zhì)量安全關(guān)鍵崗位人員履職情況;
(四)加貼中文標(biāo)簽的活動是否持續(xù)符合要求�;
(五)加貼中文標(biāo)簽的內(nèi)容是否符合相關(guān)法律法規(guī)及標(biāo)準(zhǔn)要求,是否與經(jīng)注冊或者備案的相關(guān)內(nèi)容保持一致���。
必要時�,可以采取書面檢查���、遠(yuǎn)程檢查等方式核實境內(nèi)代理人與境外注冊人���、備案人質(zhì)量管理體系銜接情況���。
第十六條 加貼中文標(biāo)簽過程中存在產(chǎn)品質(zhì)量安全隱患,未及時采取措施消除的���,上海市藥品監(jiān)督管理局�、浦東新區(qū)市場監(jiān)督管理局根據(jù)各自職責(zé)可以依法采取告誡����、責(zé)任約談、責(zé)令限期整改等措施����。
第十七條 境內(nèi)代理人加貼中文標(biāo)簽的過程不符合國家相關(guān)法規(guī)規(guī)章要求,或未按照本規(guī)定執(zhí)行�,可能影響醫(yī)療器械產(chǎn)品安全、有效的�,上海市藥品監(jiān)督管理局、浦東新區(qū)市場監(jiān)督管理局根據(jù)各自職責(zé)依照國家相關(guān)法規(guī)規(guī)章進(jìn)行處置�。
第十八條 本辦法自2025年1月1日起施行,有效期二年��,自2026年12月31日止。