適用于動靜脈瘺的建立的人工血管在我國屬于第三類醫(yī)療器械注冊產(chǎn)品���,該產(chǎn)品為多層結(jié)構(gòu)����,在膨體聚四氟乙烯(ePTFE)內(nèi)層 和聚對苯二甲酸乙二醇酯(PET)編結(jié)物外層之間�����,有加強(qiáng)型聚丙烯(PP)支撐環(huán)和硅膠層�。環(huán)氧乙烷滅菌,一次性使用��。本文為大家介紹人工血管產(chǎn)品技術(shù)要求及注冊審評要點���,一起看正文���。
適用于動靜脈瘺的建立的人工血管在我國屬于第三類醫(yī)療器械注冊產(chǎn)品���,該產(chǎn)品為多層結(jié)構(gòu),在膨體聚四氟乙烯(ePTFE)內(nèi)層
和聚對苯二甲酸乙二醇酯(PET)編結(jié)物外層之間��,有加強(qiáng)型聚丙烯(PP)支撐環(huán)和硅膠層����。環(huán)氧乙烷滅菌,一次性使用����。本文為大家介紹人工血管產(chǎn)品技術(shù)要求及注冊審評要點,一起看正文�����。
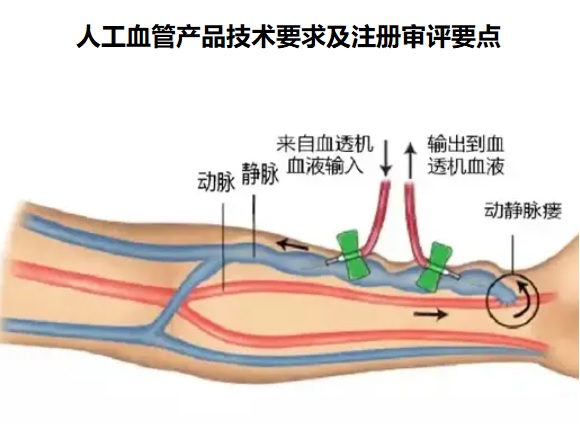
一����、人工血管的工作原理
人工血管是一種非來源于自然器官和組織的血管代用
品,人工血管可用于血液透析患者的動靜脈通路建立�,在血
液通路手術(shù)中作為皮下動靜脈通路���。
二、人工血管產(chǎn)品技術(shù)要求
人工血管產(chǎn)品技術(shù)要求中的性能指標(biāo)通常用包括:外觀��、自然狀態(tài)下內(nèi)徑����、有效長度�、壁厚、水滲透壓���、軸向拉伸強(qiáng)度��、圓周拉伸強(qiáng)度���、探針破裂強(qiáng)度、牽拉強(qiáng)度�、反復(fù)穿刺后圓周拉伸強(qiáng)度、扭結(jié)半徑��、擴(kuò)張內(nèi)徑���、動態(tài)順應(yīng)性�����、微粒污染���、單位面積重量��、還原物質(zhì)�����、蒸發(fā)殘渣�、紫外吸光度�����、酸堿度���、重金屬總量�、環(huán)氧乙烷殘留量�����、六甲基二硅氧烷殘留量、無菌����、細(xì)菌內(nèi)毒素這24項性能指標(biāo)。
三���、人工血管產(chǎn)品注冊時��,生物相容性試驗應(yīng)開展哪幾項���?
人工血管為植入器械�,與人體循環(huán)血液長期接觸。醫(yī)療器械注冊申請人依據(jù) GB/T 16886 系列標(biāo)準(zhǔn)進(jìn)行了生物相容性評價�,選擇了材料表征、毒理學(xué)評價和生物學(xué)試驗的方式進(jìn)行風(fēng)險評定�����,開展的生物學(xué)試驗包括溶血���、血栓形成�����、凝血���、熱原��、急性全身毒性��、細(xì)胞毒性��、致敏�、皮內(nèi)反應(yīng)���、植入后局部組織反應(yīng)�、遺傳毒性���、亞慢性全身毒性����;針對亞急性毒性��、慢性毒性����、致癌性終點開展了評價�����。
如有人工血管產(chǎn)品注冊咨詢服務(wù)需求��,或是其他第三類醫(yī)療器械注冊代理服務(wù)需求���,歡迎您隨時方便與杭州證標(biāo)客醫(yī)藥技術(shù)咨詢有限公司聯(lián)絡(luò),聯(lián)系人:葉工���,電話:18058734169��,微信同���。